TERCERA GUÍA DE QUÍMICA.
COLEGIO SAN JOSÉ IED.
GRADO DECIMO.
TITULO: FUNCIONES QUÍMICAS INORGÁNICAS. SEGUNDA PARTE
DOCENTE: ALIRIO GUERRERO
TEMA: NOMENCLATURA QUÍMICA INORGÁNICA.
“RESUELVA LOS CINCO PUNTOS "RESOLVER" DE ESTA ACTIVIDAD EN HOJAS BLANCAS
NUMERADAS Y ESCRITAS A MANO Y MARQUE CADA HOJA CON SU NOMBRE, ENVÍE SU ARCHIVO
AL COREO alirio8999@gmail.com. FECHA DE ENTREGA VIERNES 24 DE ABRIL.
Descripción
de la secuencia didáctica
En esta unidad didáctica
repasaremos algunos conceptos necesarios para iniciar el estudio de las funciones
químicas inorgánicas. Además, repasaremos algunas normas de nomenclatura
química inorgánica (tradicional, sistemática y stock). Así mismo, realizaremos
algunos ejercicios de construcción y asignación del nombre de algunos compuestos
químicos inorgánicos.
Trabajaremos algunos
conceptos como: tabla periódica, carácter metal y no metal de los elementos,
estados de oxidación, función química, nomenclatura química, función oxido,
función hidróxido, función ácido y función sal.
OBJETIVO:
Comprender la relación entre
los elementos de la tabla periódica y los compuestos y sustancias químicas que
forman.
Determinar de manera
correcta la función química a la que pertenece un compuesto químico de acuerdo
a su composición atómica.
CONTENIDOS A DESARROLLAR.
Tabla periódica, Estados de
oxidación, función química, funciones químicas inorgánicas.
Competencias
a desarrollar:
Desarrollar la capacidad de
lectura de la tabla periódica como herramienta en el trabajo de la química.
Construir moléculas de
compuestos a partir del uso de los estados de oxidación de los elementos.
Fomentar en los estudiantes
un conocimiento de las características y peligrosidad de sustancias químicas de
uso cotidiano.
METODOLOGÍA:
FASE1.
PREGUNTÉMONOS
Con
la información suministrada en la clase de química, con la información en
libros y consultas a internet y con la
solución de esta guía el estudiante estará en condición de resolver
preguntas como:
a. ¿cómo se
organizan los elementos en la tabla periódica?
b. ¿qué relación
existe entre el estado de oxidación de un elemento y los compuestos químicos?
c. ¿Cuáles son
las funciones químicas inorgánicas?
d. ¿a qué función
química o clase de compuestos pertenece una molécula determinada?
1.
VEAMOS CON
ATENCIÓN LA TABLA PERIÓDICA.
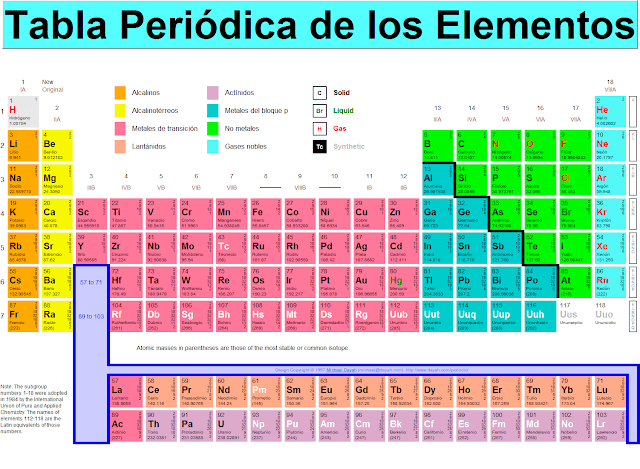

ANALICEMOS:
·
Las columnas se llaman grupos o familias y cada color
corresponde a una clase. Existe la familia A y la familia B.
·
Las filas se denominan periodos “ son siete”
·
Los lantánidos y actínidos se sacan aparte de las
filas 6 y 7.
RESOLVER
1:
Con
base en la tabla periódica escriba el nombre y símbolo de todos los elementos
de cada grupo y familia.
RESOLVER
2:
Escriba
las características de cada grupo de elementos según su estado natural.
REPASEMOS
LA TABLA CON EL SIGUIENTE VIDEO.
RESOLVER 3
Visto el video escriba cinco ideas o
conclusiones.
VEAMOS ALGUNAS PROPIEDADES DE LOS
METALES Y NO METALES






2. ESTADOS DE OXIDACIÓN O NÚMEROS DE OXIDACIÓN
TABLA PERIÓDICA CON LOS ESTADOS DE OXIDACIÓN DE LOS
ELEMENTOS

Los estados de oxidación o número de oxidación de un átomo
es el número de electrones que gana, pierde o comparte cuando se une a otro átomo
en un enlace para formar una molécula compuesto.
ALGUNOS ESTADOS DE OXIDACIÓN:


ANALICEMOS LA ANTERIOR TABLA:
·
El hidrogeno tiene estado de oxidación +1 y -1) es
decir, cuando se une a otro átomo y pierde su único electrón de enlace o de
Valencia adquiere carga positiva, se oxida y se convierte en el ion “catión” con carga positiva H+1.
Así
mismo, si el hidrogeno recibe el electrón de enlace de otro átomo, se reduce,
adquiere carga negativa y se convierte en un ion “anión” con carga negativa H -
·
El helio y
cualquier elemento que se halle solo, sin combinarse con otro elemento su
estado de oxidación es cero.
·
El carbono presenta estados de oxidación positivos y
negativos (+1, +2,+3, +4 y -1, -2, -3) .esto significa que el carbón al unirse
a otro elemento puede perder 1, 2,3 ó 4 electrones. o también puede llegar a
ganar 1, 2 ó 3 electrones dependiendo de la molécula o compuesto que este
formando.
Refuerza con el siguiente
video
RESOLVER
4:
·
Se analizaron tres elementos y sus estados de oxidación, ahora examina y
explica los otros elementos de la tabla.
CASOS ESPECIALES DE ESTADOS DE OXIDACIÓN DE ALGUNOS
ELEMENTOS SEGÚN LA CLASE DE COMPUESTOS EN LOS QUE SE ENCUENTRA.
a. EL HIDROGENO:
·
H-1 (en los compuestos llamados hidruros)
·
H+1 (en los compuestos llamados hidróxidos,
ácidos y sales)
b. EL OXIGENO:
·
O-1 (en los compuestos llamados peróxidos)
·
O-2 (en los compuestos llamados óxidos,
hidróxidos, ácidos anhídridos y sales oxigenadas)
·
O-1/2 ( en los compuestos llamados superóxidos)
c. Todos los
elementos del grupo IA tiene número de oxidación (+1)
d. Todos los
elementos del grupo II A tiene número de oxidación +2)
3.
BALANCE
ELÉCTRICO DE LAS MOLÉCULAS.
Todas las moléculas que representan compuestos o
sustancias químicas deben estar eléctricamente neutras. Significa que al sumar algebraicamente
los estados de oxidación de los elementos de la molécula la suma debe ser cero.
VEAMOS
UN EJEMPLO.
ANÁLISIS:
·
La molécula H2SO4 es el ácido
sulfúrico.
·
En la molécula hay 2 átomos de hidrogeno, un átomo de
azufre y 4 átomos de oxígeno.
·
Al formar la molécula se le asigna a cada elemento el
estado de oxidación menor.
·
Como es un ácido el estado de oxidación del hidrogeno es
+1, el estado de oxidación del oxígeno es -2.
·
La molécula quedaría así: H2+1SO4-2.
·
¿cómo se
calcula el estado de oxidación del azufre S? se multiplican los dos átomos
del hidrogeno por su carga +1: (2x1 = 2).
Luego se multiplican los 4 átomos de oxigeno por su carga -2: (4 x -2 = -8).
Para que la suma de cargas de cero la carga del azufre
debe ser +6.
Finalmente la molécula queda así: H2+1 S+6O4-2
Análisis numérico

RESOLVER
5.
Seleccione
una de las siguientes moléculas donde el símbolo del primer elemento, que no
sea Hidrogeno ni oxigeno contenga la primer letra de su primer apellido o la
más cercana. A esa molécula elegida, asignarle los
estados de oxidación que le correspondan a cada elemento según los valores
encontrados en la tabla periódica.
MOLÉCULAS
Al2O3, AgNO3, H3BO3, H2CO3, CaF2,
Ga2S3, H I, Li2O,
MnO2, HNO₃,
MgSO4, H3PO4, RhO2, SO3, TeO2, UO2,
V2O5, Y2O3,
ZnSO₄